Metode Baru Mendeteksi Interaksi Ligan-Protein Dengan Sensitivitas yang Belum Pernah Ada Sebelumnya

PELSA adalah metode yang sensitif dan serbaguna untuk mengidentifikasi protein dan situs pengikat ligan dalam sistem asli tanpa memerlukan modifikasi ligan. Ini mengungguli pendekatan tradisional dalam hal sensitivitas, terutama untuk interaksi metabolit afinitas rendah, dan menawarkan aplikasi luas dalam desain obat dan studi biologi.
Sebuah tim peneliti yang dipimpin oleh Prof. Mingliang Ye dari Dalian Institute of Chemical Physics, Chinese Academy of Sciences (CAS), bekerja sama dengan kelompok Prof. Cheng Luo dari Shanghai Institute of Materia Medica, CAS, telah mengembangkan teknik proteomik yang sangat sensitif. dikenal sebagai uji stabilitas lokal peptida-sentris (PELSA). Diterbitkan di Metode Alammetode inovatif ini memungkinkan identifikasi simultan protein pengikat ligan dan situs pengikatannya dalam sistem yang kompleks. PELSA sangat serbaguna, dapat diterapkan pada berbagai ligan seperti metabolit, obat-obatan, dan polutan.
Interaksi protein dengan ligan—bertindak sebagai substrat enzim, inhibitor, molekul pemberi sinyal, modulator alosterik, atau jangkar struktural—sangat penting bagi fungsi biokimianya.
Mengkarakterisasi interaksi protein-ligan sangat penting untuk mengidentifikasi fungsi protein yang tidak dikarakterisasi, mempelajari mekanisme pengaturan metabolisme sel, dan memahami mekanisme kerja obat. Selain itu, menentukan daerah pengikatan ligan sangat berharga untuk desain obat berbasis struktur dan merumuskan hipotesis biologis.
Keterbatasan Metode Tradisional
Metode tradisional untuk menentukan lokasi pengikatan dan afinitas biasanya memerlukan pemurnian protein rekombinan, yang dapat memakan waktu dan tenaga. Selain itu, protein yang dimurnikan mungkin tidak sepenuhnya mereplikasi keadaan seluler aslinya, sehingga menghasilkan pengukuran afinitas yang tidak akurat. Metode proteomik berbasis modifikasi menawarkan solusi ampuh untuk mengidentifikasi protein pengikat ligan dan situsnya secara langsung pada lisat seluler asli. Namun, seringkali memerlukan modifikasi ligan, yang dapat mempengaruhi aktivitas ligan dan tidak dapat diterapkan pada ligan yang tidak dapat dimodifikasi.
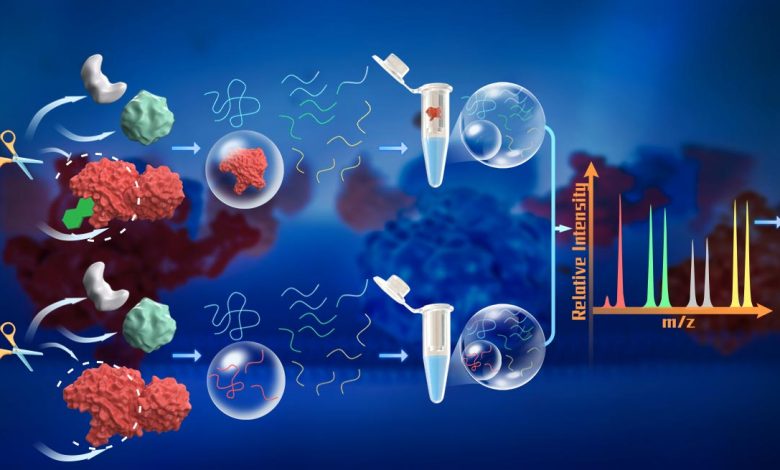
Dalam metode yang diusulkan dalam penelitian ini, para peneliti menggunakan sejumlah besar trypsin (rasio E/S 1:2) untuk secara langsung menghasilkan peptida kecil dari protein asli. Karena peptida ini dihasilkan dalam kondisi asli, kelimpahannya mewakili ukuran stabilitas lokal protein.
Jumlah trypsin yang besar memastikan bahwa bahkan segmen protein dalam keadaan energi rendah dapat dibelah, menghasilkan pembentukan peptida dalam jumlah besar yang mencerminkan stabilitas lokal protein. Peptida ini dipisahkan dari protein yang dicerna sebagian, dikumpulkan, dan dianalisis langsung dengan spektrometri massa. Dengan mengukur kelimpahan peptida dalam sampel yang diberi perlakuan ligan dan sampel yang diberi perlakuan kendaraan, daerah pengikatan ligan dan protein pengikat yang sesuai kemudian dapat ditentukan.
Peningkatan Sensitivitas dan Keandalan
PELSA telah menunjukkan sensitivitas yang unggul dalam identifikasi protein target. Misalnya, dalam mengidentifikasi protein target staurosporin penghambat pan-kinase, PELSA menunjukkan peningkatan 12 kali lipat dalam identifikasi target kinase dibandingkan dengan metode bebas modifikasi yang canggih, LiP-MS. Dibandingkan dengan teknik thermal proteome profiling (TPP) yang banyak digunakan, yang tidak memiliki informasi situs pengikatan, PELSA mengidentifikasi target kinase 2,4 kali lipat lebih banyak. Eksperimen PELSA yang bergantung pada dosis dapat mengukur afinitas lokal, memberikan wawasan tentang perubahan struktural protein dinamis pada pengikatan ligan dalam kondisi fisiologis.
Metabolit, yang dikenal karena keragaman strukturalnya dan seringkali memiliki afinitas rendah terhadap protein, menimbulkan tantangan. PELSA terbukti sangat efektif untuk identifikasi sistematis protein pengikat metabolit. Misalnya, PELSA mengidentifikasi 40 kandidat protein target untuk alfa-ketoglutarat dalam lisat sel HeLa, 30 di antaranya merupakan protein pengikat alfa-ketoglutarat yang terkenal, yang menunjukkan sensitivitas dan keandalan metode yang tinggi. Selain itu, PELSA mengidentifikasi protein pengikat untuk metabolit lain, seperti folat, leusin, fumarat, dan suksinat, yang menunjukkan penerapannya yang luas.
PELSA dapat secara langsung mendeteksi pergeseran stabilitas lokal protein yang diinduksi ligan dalam lisat sel total tanpa memerlukan modifikasi kimiawi ligan. Hal ini berlaku secara luas untuk beragam ligan, dan memungkinkan analisis sistematis protein pengikat ligan, situs pengikatannya, dan afinitas pengikatan lokal dalam sel lisat, di mana protein membawa modifikasi fisiologis pasca-translasi dan berhubungan dengan protein yang berinteraksi.
Referensi: “Uji stabilitas lokal yang berpusat pada peptida memungkinkan identifikasi skala proteom dari target protein dan daerah pengikatan berbagai ligan” oleh Kejia Li, Shijie Chen, Keyun Wang, Yan Wang, Lianji Xue, Yuying Ye, Zheng Fang, Jiawen Lyu , Haiyang Zhu, Yanan Li, Ting Yu, Feng Yang, Xiaolei Zhang, Siqi Guo, Chengfei Ruan, Jiahua Zhou, Qi Wang, Mingming Dong, Cheng Luo dan Mingliang Ye, 10 Desember 2024, Metode Alam.
DOI: 10.1038/s41592-024-02553-7